~REAKSI REDOKS DAN ELEKTROKIMIA~
-PETA KONSEP-
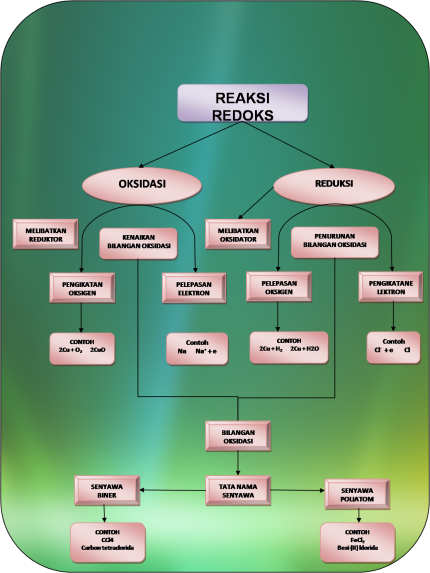
Perkembangan Konsep Reaksi Redoks
|
Konsep |
Oksidasi |
Reduksi |
|
Peristiwa bereaksinya suatu zat dengan oksigen. 4Na + O2 2Na2O |
Peristiwa pelepasan oksigen dari suatu zat. FeO + H2 Fe + H2O |
|
Peristiwa pelepasan elektron oleh suatu zat. Na Na+ + e |
Peristiwa penerimaan elektron oleh suatu zat. F + e F– |
|
Peristiwa kenaikan biloks |
Peristiwa penurunan biloks |
|
Zn + HCl => ZnCl2 + H2 0 +1 +2 0 |__________| Oks |____________| Reduksi |
||
Penyetaraan Reaksi Redoks
Metode Perubahan Bilangan Oksidasi
- Setarakan atom-atom yang mengalami perubahan biloks
- Tentukan biloks unsur-unsur tersebut dan tentukan perubahannya
- Samakan kedua perubahan biloks
- Tentukan jumlah muatan diruas kiri dan kanan
- Samakan muatan dengan cara :
Jika muatan diruas kiri lebih negatif maka ditambahkan ion H+ sebanyak perbedaan muatan.
Jika muatan diruas kanan lebih positif maka ditambahkan ion– sebanyak perbedaan muatan. -
Samakan atom hidrogen diruas kiri dan kanan dengan cara menambahkan H2O
Metode Setengah Reaksi
-
Tuliskan persamaan setengah reaksi reduksi dan setengah reaksi oksidasi
-
Setarakan unsur-unsur yang mengalami perubahan biloks
-
Tambahkan satu molekul H2O :
Pada yang kelebihan atom O, jika reaksi berlangsung dalam suasana
Pada yang kekurangan atom O, jika reaksi berlangsung dalam suasana asam -
Setarakan atom hidrogen dengan ion H+, jika suasana asam atau dengan ion OH – , jika suasana basa
-
Setarakan muatan dengan penambahan elektron
-
Jumlahkan kedua persamaan setengah reaksi dengan menyamakan elektron
Beberapa Oksidator dan Perubahannya
|
No. |
Oksidator |
Rumus |
Perubahan (½ reaksi Reduksi) |
|
1. |
Batu Kawi |
MnO2 |
MnO2 => Mn2+ |
|
2. |
Kalium Permanganat |
KMnO4 |
M nO4– asam Mn2+ dan MnO4– basa MnO2 |
|
3. |
Kalium bikromat |
K2Cr2O7 |
Cr2O72+ => Cr3+ |
|
4. |
Kalium klorat |
KClO3 |
ClO3– => Cl– |
|
5. |
Asam Yodat |
HIO3 |
IO3– => I– |
|
6. |
Hidrogen peroksida |
H2O2 |
H2O2 asam H2O dan H2O2 basa OH– |
|
7. |
Asam Sulfat pekat |
H2SO4 |
SO4-2 => SO2 |
|
8. |
Asam Nitrat pekat |
HNO3 |
NO3– => NO2 |
|
9. |
Asam Nitrat encer |
HNO3 |
NO3– => NO |
|
10. |
Ion Hidrogen |
H+ |
H+ => H2 |
|
11. |
Halogen |
X2 |
X2 => X– |
|
12. |
Ozon |
O3 |
O3 => O2 |
Pada reaksi IODOMETRI : I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Sel Elektrokimia
-
Sel elektrokimia adalah tempat terjadinya aliran elektron yang ditimbulkan oleh konversi energi kimia menjadi energi listrik atau sebaliknya. Hal ini dimungkinkan dengan pemisahan reaksi oksidasi dan reaksi reduksi (reaksi redoks).
-
Terdapat dua macam sel elektrokimia, yaitu sel Volta (sel Galvani ) dan sel elektrolisis:
-
Sel volta adalah sel elektrokimia yang melibatkan reaksi redoks spontan dan menghasilkan arus listrik.
-
Sel elektrolisis adalah sel elektrokimia yang melibatkan reaksi redoks tidak spontan dan memerlukan arus lisrik luar.
- Persamaan sel volta dengan sel elktrolisis:
-
- Reaksi oksidasi berlangsung di anode dan reaksi reduksi berlangsung di katode
- Pada rangkaian luar, elekron mengalir melalui kawat dari anode ke katode.
-
Elektrolit merupakan zat yang menghantarkan listrik di dalam sel. Arus listrik dibawa oleh anion ke anode dan oleh kation ke katode.
- Perbedaan sel volta dengan sel elektrolisis:
-
Sel Volta
Sel Elektrolisis
-
Melibatkan reaksi redoks spontan.
-
Elektron mengalir dari elektrode negatif (anode).
-
Mengubah energi kimia menjadi energi listrik.
-
Terdiri dari dua setengah sel dengan elektrolit terpisah.
- Katode bermuatan positif (reduksi).
- Anode bermuatan negatif (oksidasi)
-
Melibatkan reaksi redoks tidak spontan.
-
Elektron mengalir dari elektrode positif (anode).
-
Mengubah energi listrik menjadi energi kimia.
-
Elektrode-elektrode dicelupkan dalam elektrolit yag sama.
- Katode bermuatan negatif (reduksi).
- Anode bermuatan positif (oksidasi)
-
Sel Volta/Galvani
-
Potensial elektrode standar (Eo), adalah potensial elektrode (potensial reduksi) yang diukur pada suhu 25oC dan tekanan parsial 1 atm, dimana konsentrasi ion-ion yang terlibat dalam reaksi adalah 1 M.
-
Potensial elektrode standar dapat digunakan untuk memperkirakan apakah suatu reaksi redoks berlangsung secara spontan atau tidak .
-
Potensial sel adalah kemampuan maksimum sel untuk mendorng elektron mengalir melalui rangkaian luar.
-
Sel volta digolongkan menjadi sel primer, sel sekunder dan bahan bakar.
-
Reaksi kimia yang menghasilkan energi listrik
-
Katode : kutub (+)
Anode : kutub (–)
- Potensial listrik yang dihasilkan sel Volta disebut potensial sel (Eosel ). Reaksi berlangsung spontan bila besarnya Eosel = positif (+).
Eosel = Eo reduksi – Eo oksidasi
Gambar Sel Volta :

Katode : – logam Cu Anode : – logam Zn
- elektrode (+) – elektrode (–)
- mengalami reduksi – oksidasi
Reaksi redoksnya dapat ditulis :
Anoda (–) : Zn → Zn2+ + 2e Eo = 0,76 v
Katode (+) : Cu2+ + 2e → Cu Eo = 0,34 v
————————————————-
Redoks : Zn + Cu2= → Zn2+ + Cu Eo sel = 1,1 v
Deret Volta :
Li–K–Ba–Ca–Na–Mg–Al–Mn–(H2O)–Zn–Cr–Fe–Cd–Ni–Co–Sn–Pb–H–Cu–Hg–Ag–Pt–Au
-
Makin ke kiri : Eo kecil, mudah dioksidasi, reduktor kuat, logam makin reaktif
-
Makin ke kanan : Eo besar, mudah direduksi, oksidator kuat, logam kurang reaktif
Beberapa Sel Volta Komersial :
Aki
-
Sel aki terdiri atas anode Pb dan katode PbO2, keduanya merupakan zat padat, yang dicelupkan dalam larutan asam sulfat.
-
Reaksi pengosongan aki :
Anode : Pb + HSO4 – → PbSO4 + H+ + 2e
Katode : PbO2 + HSO4 – + 3H+ + 3e → PbSO4 + 2H2O
———————————————————–
Pb + PbO2 + 2HSO4 – + 2H+ → 2PbSO4 + 2H2O -
Reaksi pengisian aki :
Katode (Pb) : PbSO4 + H+ + 2e → Pb + HSO4 –
Anode (PbO2) : PbSO4 + 2H2O → PbO2 + HSO4 – + 3H+ + 2e
————————————————————————
2PbSO4 + 2H2O → Pb + PbO2 + 2HSO4 – + 2H+Baterai Kering
-
Terdiri atas suatu silinder seng (anode) yang berisi pasta dari campuran batu kawi (MnO2), salmiak (NH4Cl), grafit (katode), dan sedikit air.
-
Reaksi :
Anode : Zn → Zn2+ + 2e
Katode : 2MnO2 + 2NH4+ + 2e → Mn2O3 + 2NH3 + H2O
————————————————————————-
Zn + 2NH4+ + 2MnO2 → Zn2+ + Mn2O3 + 2NH3 + H2O
Sel Elektrolisis
-
Reaksi kimia yang memerlukan energi listrik
-
Katode : kutub (–)
Anode : kutub (+)
-
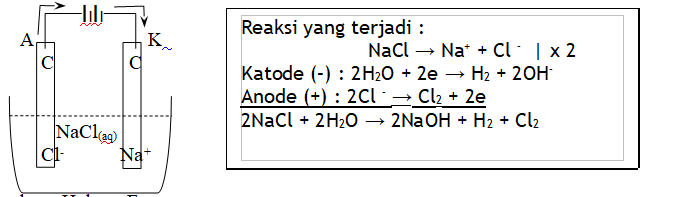
Elektrolisis leburan / lelehan / cairan : unsur-unsur yang terlibat dalam reaksi adalah kation, anion dan elektrodenya.
- Elektrolisis larutan : unsur-unsur yang terlibat dalam reaksi adalah kation, anion, pelarut (air), dan elektrodenya.
- Skema reaksi-reaksi elektrolisis larutan :

- Logam aktif (golongan IA, IIA, Al dan Mn) kationnya akan tereduksi menjadi logamnya, bila yang dielektrolisis adalah lelehan/leburan/cairanya
- Pada pelapisan/penyepuhan logam yang digunakan sebagai anode adalah logam pelapis
-
Susunan Sel Elektrolisis
- Hukum Hukum Faraday
Hukum Faraday I : W = eF = eit/96500 = eQ/96500
Hukum Faraday II : W1/e1 = W2/e2 , bila arus sama atau (mol)(jumlah elektron)1 = (mol)(jumlah elektron)2Penggunaan Elektrolisis
- Untuk memproduksi suatu zat
- Untuk pemurnian logam, dengan prinsip logam kotor sebagai anode dan logam murni sebagai katode.
- Untuk penyepuhan (elektroplatting), dengan prinsip Logam yang akan disepuh sebagai katode, logam penyepuh sebagai anode elektrolit yaitu larutan yang mengandung ion logam penyepuh. massa logam penyepuh akan berkurang
See More :Ebook Reaksi Redoks Dan Elektrokimia (Klik Disini) |

Referensi: |
http://fiskadiana.blogspot.co.id/2014/12/reaksi-redoks-dan-elektrokimia.html

