
~HIDROLISIS GARAM~
-PETA KONSEP-

PENGERTIAN HIDROLISIS GARAM
Sebagaimana kita ketahui bahwa jika larutan asam direaksikan dengan larutan basa akan membentuk senyawa garam. Jika kita melarutkan suatu garam ke dalam air, maka akan ada dua kemungkinan yang terjadi, yaitu: Ion-ion yang berasal dari asam lemah (misalnya CH3COO– , CN– , dan S2– ) atau ion-ion yang berasal dari basa lemah (misalnya NH4+, Fe2+, dan Al3+) akan bereaksi dengan air. Reaksi suatu ion dengan air inilah yang disebut hidrolisis. Berlangsungnya hidrolisis disebabkan adanya kecenderungan ion-ion tersebut untuk membentuk asam atau basa asalnya.
Contoh:
CH3COO– + H2O ⎯⎯→ CH3COOH + OH–
NH4+ + H2O ⎯⎯→ NH4OH + H+
Ion-ion yang berasal dari asam kuat (misalnya Cl–, NO3–, dan SO42–) atau ion-ion yang berasal dari basa kuat (misalnya Na+, K+, dan Ca2+) tidak bereaksi dengan air atau tidak terjadi hidrolisis. Hal ini dikarenakan ion-ion tersebut tidak mempunyai kecenderungan untuk membentuk asam atau basa asalnya. (Ingat kembali tentang kekuatan asam-basa).
Na+ + H2O ⎯⎯→ tidak terjadi reaksi
SO42– + H2O ⎯⎯→ tidak terjadi reaksi
Hidrolisis hanya dapat terjadi pada pelarutan senyawa garam yang terbentuk dari ion-ion asam lemah dan ion-ion basa lemah. Jadi, garam yang bersifat netral (dari asam kuat dan basa kuat) tidak terjadi hidrolisis.
JENIS HIDROLISIS GARAM
Hidrolisis garam di bedakan menjadi 2, yaitu sebagai berikut:
- Hidrolisis garam sebagian (parsial)
Hidrolisis garam sebagian adalah reaksi garam dengan air dimana yang bisa bereaksi hanya anion nya saja atau kation nya saja. Garam yang mengalami hidrolisis sebagian yaitu:
1. Garam yang terbentuk dari asam lemah dan basa kuat
2. Garam yang terbentuk dari asam kuat dan basa lemah - Hidrolisis garam total
Hidrolisis garam total adalah reaksi garam dengan air dimana semua ion garam dapat bereaksi dengan air, baik kation maupun anion nya. Garam yang mengalami hidrolisis total, yaitu garam yang terbentuk dari asam lemah dan basa lemah.
MACAM-MACAM GARAM YANG DIREAKSIKAN DARI REAKSI ASAM-BASA
1. Garam yang terbentuk dari asam lemah dan basa kuat
Garam yang berasal dari asam lemah dan basa kuat dalam air mengalami hidrolisis sebagian. Komponen garam (anion asam lemah) mengalami hidrolisis menghasilkan ion OH-, maka pH > 7 sehingga larutan garam bersifat basa. Contoh CH3COOK, CH3COONa, KCN, CaS, dan sebagainya.
Reaksi ionisasi : CH3COOK(aq) → K+(aq) + CH3COO–(aq)
Reaksi hidrolisis : K+(aq) + H2O(l) -/-> (tidak terhidrolisis)
CH3COO–(aq) + H2O(l) → CH3COOH(aq) + OH–(aq) bersifat basa
Rumus :

Keterangan :
Kh = konstanta hidrolisis
Kw = konstanta air
Ka = konstanta asam
[G] = konsentrasi garam
h = derajat hidrolisis
Untuk menentukan besarnya derajat hidrolisis garam yang berasal dari asam lemah dan basa kuat di gunakan rumus berikut:

Contoh: Jika 50 mL larutan KOH 0,5 M di campur dengan 50 mL larutan CH3COOH 0,5 M, maka hitung pH campuran yang terjadi (Ka = 10-6)!
Jawab:
KOH + CH3COOH => CH3COOK + H2O
M : 25 mmol 25 mmol 0 mmol 0 mmol
R : 25 mmol 25 mmol 25 mmol 25 mmol-
S : 0 mmol 0 mmol 25 mmol 25 mmol
pOH = – log 5 . 10-5 = 5 – log 5
pH = 14 – (5 – log 5) = 9 + log 5
2. Garam yang terbentuk dari asam kuat dan basa lemah
Garam yang berasal dari asam kuat dan basa lemah dalam air mengalami hidrolisis sebagian karena salah satu komponen garam (kation basa lemah) mengalami hidrolisis menghasilkan ion H+, maka pH < 7 sehingga larutan garam bersifat asam. Contoh (NH4)2SO4, AgNO3, NH4CI, CuSO4 dan sebagainya.
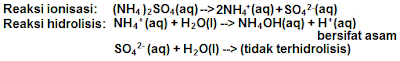
Rumus:

Keterangan:
Kh = konstanta hidrolisis
Kw = konstanta air
Kb = konstanta basa
[G] = konsentrasi garam
h = derajat hidrolisis
Untuk menentukan besarnya derajat hidrolisis garam yang berasal dari asam kuat dan basa lemah digunakan rumus:
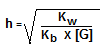
Contoh: Diketahui 250 mL larutan (NH4)2SO4 0,1 M, Kb = 2 x 10-5. tentukan pH larutan tersebut!
Jawab:

pH = – log 10-5 = 5
Jadi pH larutan tersebut adalah 5.
3. Garam yang terbentuk dari asam lemah dan basa lemah
Garam yang berasal dari asam lemah dan basa lemah dalam air mengalami hidrolisis total, karena kedua komponen garam (anion asam lemah dan kation basa lemah) terhidrolisis menghasilkan ion H+dan ion OH-, sehingga harga pH larutan ini tergantung harga Ka dan Kb. Contoh: NH4CN, (NH4)2S, CH3COONH4, dan sebagainya.

Rumus:
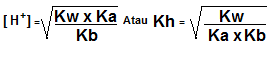
Keterangan:
Kw = konstanta air
Ka = konstanta asam
Kb = konstanta basa
Kh = konstanta hidrolisis
Harga pH dari garam yang terbentuk dari asam lemah dan basa lemah tergantung harga Ka dan Kb
1. Jika Ka = Kb, maka larutan akan bersifat netral (pH = 7)
2. Jika Ka > Kb, maka larutan akan bersifat asam (pH < 7)
3. Jika Ka < Kb, maka larutan akan bersifat basa (pH > 7)
Contoh: Hitunglah pH larutan CH3COONH4 0,1 M. Jika di ketahui Ka CH3COOH = 10-10 !
Jawab:

4. Garam yang terbentuk dari asam kuat dan basa kuat
Garam yang berasal dari asam kuat dan basa kuat dalam air tidak mengalami hidrolisis. Karena kedua komponen garam tidak terhidrolisis sehingga pH larutan sama dengan air, yaitu pH = 7 bersifat netral. Contoh: NaCI, Na2SO4, NaNO3, KCI, K2SO4, Ba(NO3)2, dan sebagaimana:
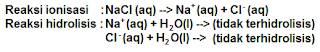
See More :
|

| Referensi: |
http://www.materibelajar.id/2016/04/hidrolisis-garam-pengertian-definisi.html
http://elissapr.blogspot.co.id/2016/07/makalah-tentang-hidrolisis-garam.html
